Tartalom
- Időszakos szervezés
- Tudományos indokok
- Lúg és alkáliföldfémek
- Átmeneti fémek
- Metalloidok és nemfémek
- Nemesgázok
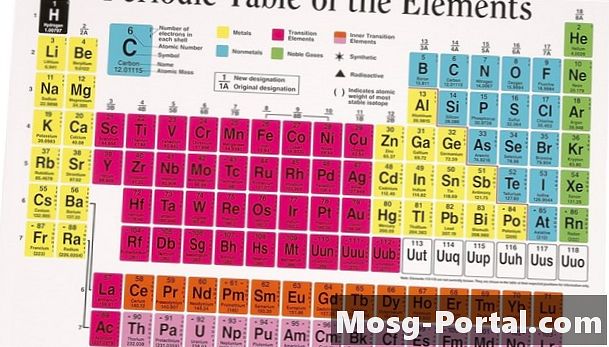
A periódusos rendszer, amely tartalmazza a természetben előforduló és őrült módon előállított kémiai elemeket, minden kémiai tanterem központi pillére. Ez az osztályozási módszer egy 1869-es könyvből származik, amelyet Dmitrij Ivanovics Mendelejev írt. Az orosz tudós észrevette, hogy amikor az ismert elemeket az atomtömeg növekedése alapján írta, könnyen sorba rendezheti azokat hasonló tulajdonságok alapján. Meglepő módon a hasonlóságok annyira megkülönböztetőek voltak, hogy Mendelejev hagyott helyet hagyni több fel nem fedezett elem számára periodikus osztályozása során.
Időszakos szervezés
A periódusos táblázatban az elemet függőleges csoportja és vízszintes periódusa határozza meg. Minden egyes szakasz, 1-7-ig számozva, növekvő atomszámú elemeket tartalmaz.A Mendelejev eredeti listájával ellentétben a modern periódusos rendszer az atomszámon vagy az elemek atommagjában lévő protonok számán alapul. A protonszám logikus választás az elemek megszervezéséhez, mivel a protonok meghatározzák egy atom kémiai azonosságát, míg az atomtömeg az egyes atomi izotópoktól függően változik. Tizennyolc oszlop van a periódusos táblázatban, általában csoportokra hivatkoznak. Mindegyik csoport több olyan elemet tartalmaz, amelyek hasonló fizikai tulajdonságokkal rendelkeznek az alapvető atomszerkezetük miatt.
Tudományos indokok
Az atom az anyag legkisebb megoszlása, amely kémiai elemként megőrzi identitását; egy központi magból áll, amelyet elektronikus felhő vesz körül. A mag pozitív töltéssel rendelkezik a protonok miatt, amelyek vonzzák a kicsi, negatív töltésű elektronokat. A semleges atom elektronjai és protonjai azonos számban vannak. Az elektronok keringési sorrendbe vagy héjba vannak rendezve a kvantummechanika alapelvei miatt, amelyek korlátozzák az elektronok számát az egyes héjakon. Az atomok közötti kémiai kölcsönhatások általában csak az utolsó héj külső elektronjait érintik, amelyeket valencia elektronoknak hívnak. Az egyes csoportok elemei azonos számú vegyérték-elektronmal rendelkeznek, így hasonlóan reagálnak, amikor elektronokat nyernek vagy veszítenek más atomokhoz. Az elektronhéjak mérete növekszik, ami a periodikus tábla növekvő periódusméretét okozza.
Lúg és alkáliföldfémek
A periódusos rendszer bal oldali bal oldali része két erősen reaktív fémet tartalmaz. Az első oszlop a hidrogén kivételével lágy, fényes alkálifémekből áll. Ezeknek a fémeknek csak egy elektron van a vegyértékhéjukban, amelyet kémiai reakciók során könnyen adományoznak egy másik atomhoz. Robbanásveszélyes reakcióképességük miatt mind a levegőben, mind a vízben az alkálifémek ritkán találhatók elemi formában a természetben. A második csoportban az alkáliföldfémeknek két vegyérték-elektronuk van, így kissé nehezebbé és kevésbé reaktívvá válnak. Ezek a fémek azonban még mindig ritkán találhatók elemi formájukban.
Átmeneti fémek
A periódusos rendszerben szereplő elemek többségét fémekként osztályozzák. Az átmeneti fémek az asztal közepén fekszenek, és a 3–12. Csoportra terjednek. Ezek az elemek szobahőmérsékleten szilárd anyagok, a higany kivételével, és fémek színének és alakíthatóságának a fémeknél várhatóak. Mivel a valenciahéjak annyira nagyok, néhány átmeneti fémet kivonnak a periódusos táblázatból, és a diagram aljára csatolják; ezeket lantanideknek és aktinideknek nevezik. A periódusos rendszer alján található átmeneti fémek közül sok ritka és instabil.
Metalloidok és nemfémek
A periódusos rendszer jobb oldalán egy durva átlós vonal osztja el a bal oldali fémeket a jobb oldalon lévő nemfémektől. Ezen a vonalon átnyúló fém tulajdonságokkal bírnak a metalloidok, például germánium és arzén. A kémikusok az ezen elválasztó vonaltól jobbra lévő összes elemet nem fémekként osztályozzák, kivéve a jobboldali 18. csoportot. A nemfémek közül sok gáz halmazállapotú, és mindegyik figyelemre méltó elektron-nyerési és valenciahéj-kitöltési hajlandósága miatt.
Nemesgázok
A periódikus táblázat jobb szélén, a 18. csoport teljes egészében gázokból áll. Ezeknek az elemeknek teljes valencia héja van, és nem hajlanak sem elektronok nyerésére, sem elvesztésére. Ennek eredményeként ezek a gázok szinte kizárólag elemi formában léteznek. A vegyészek nemes vagy inert gázokba sorolják őket. Az összes nemesgáz színtelen, szagtalan és nem reagál.