Az atom, amelyben azonos számú proton és elektron van, nem sem pozitív, sem negatív - nincs nettó töltése. Ha azonban az atom elektronokat veszít vagy veszít, akkor kationból, pozitív töltésű ionokká vagy anionokká válhat negatív töltésű ionokká. A vegyészek nagyon egyszerű jelölést alkalmaznak az ionok ábrázolására a kémiai reakciókban. Noha meg kell emlékeznie néhány általános poliatómionra, a legtöbbször az periodikus táblázat segítségével kitalálhatja az ionok szimbólumait.
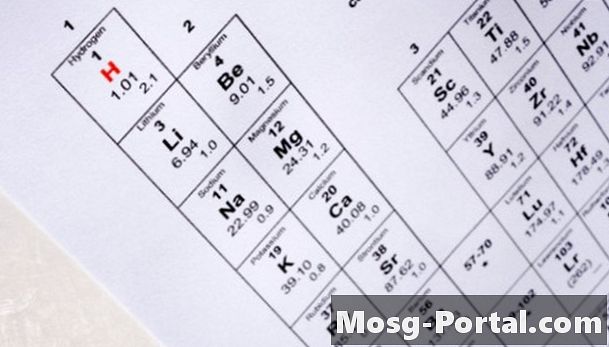
Határozza meg, hogy az ion csak egyetlen elemet tartalmaz-e. Ha igen, keresse meg a periódusos táblán ionizált elemet. Az első oszlopban például a nátrium, míg a másodikban a nátrium található.
Írja le az elem egy- vagy kétbetűs szimbólumát a periódusos táblából. A nátrium szimbóluma például Na, míg a kalcium szimbóluma Ca.
Határozza meg, hogy hány elektron veszített el vagy nyert atomot. A periódusos rendszer 1. oszlopában szereplő elemek (például nátrium és kálium) elveszítik az elektronot, amikor reagálnak, míg a második oszlop elemei (például kalcium, magnézium és stroncium) általában két elektronot veszítenek, amikor reagálnak. A 17. csoport elemei, a halogének (fluor, klór, bróm és jód) szinte mindig ionokat képeznek, amelyek egyetlen elektronot nyernek. A kén és az oxigén ionokat képezhetnek -2 töltéssel. A táblázat közepén lévő elemek - az úgynevezett átmeneti fémek - változó számú elektronot veszíthetnek el. Az átmenetifém-atom elvesztett elektronjainak számát római számokkal kell megadni a neve után. Például a vas (III) három elektronot, míg a vas (II) kettőt elveszített.
Írja be a negatív jelet felső indexként, majd kövesse az atomok által elért elektronok számát VAGY írjon pozitív jelet felülíróként, majd kövesse az elvesztett elektronok számát.
Példa: A kalciumiont Ca + 2-ként írnánk (a +2 feliratként).
Határozzuk meg, hogy az ion tartalmaz-e egynél több elemet (például a szulfát-iont). Ha igen, keresse meg a nevét az alábbi Erőforrások szakasz alatt található táblázatban. Minden névnek van egy szimbóluma, amely megfelel neki. A szulfát például SO4 -2 (a -2 felsõ és a 4 felsõ indexként, mivel 4 oxigénatom van).