
Tartalom
A kémiai kötési szabályok az atomokra és a molekulákra vonatkoznak, és ezek képezik a kémiai vegyületek képződésének alapját. A kémiai kötés, amely kettő vagy több atom között képződik, egy elektromágneses vonzóerő két ellentétes töltés között. Az elektronok negatív töltésűek, és egy atom pozitív töltésű magja vonzza őket egy pályára vagy tartja azokat egy pályán.
Szabályok az elektronokra
Fotolia.com "> ••• Oleg kép: Oleg Verbitsky, a Fotolia.com-tólA negatív töltésű elektronok körbe kerítik vagy keringnek egy atom pozitív töltésű magját (középső tömege). Az elektronokat a pályájukon keresztül tartják a mag vonzása. Vegyi vegyület képződésénél egy második atom is húzza az elektronokat oly módon, hogy mindkét atom elektronjának legstabilabb konfigurációja a központban legyen. Bizonyos értelemben az elektronokat a két mag osztja meg, és kémiai kötés alakul ki. Ezek az atomok közötti kémiai kötések diktálják az anyag szerkezetét.
Kovalens és ionos kötések

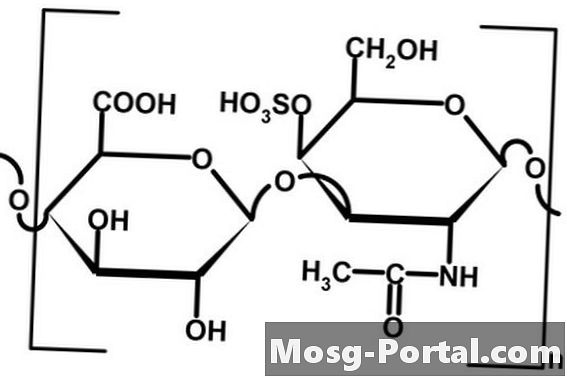
••• kondroitin-szulfát kép: Cornelia Pithart, a Fotolia.com-tól
A kovalens és ionos kötés erős kémiai kötés. Kovalens kötésben az atomok az atomok között megoszlanak és léteznek a két atom közötti térben. A negatív töltésű elektronokat mindkettő magához vonzza, egyenlően vagy egyenlőtlenül. Az atomok közötti egyenlőtlen elektron-megoszlást poláris kovalens kötésnek nevezzük. Az ionkötések nem foglalják magukban az elektronok megosztását, hanem az elektronátvitelt. Az egyik atomból származó elektron elhagyja atomi pályáját, amely olyan üreget hoz létre, amely lehetővé teszi más atomok elektronjainak hozzáadását. Az atomok közötti kötés elektrosztatikus vonzerő, mivel egy atom kissé pozitívabb, egy pedig kissé negatív.
A gyengébb kötvény erősségei

A gyenge kémiai kötésekre példa a dipol-dipol kölcsönhatások, a londoni diszperziós erő, a Van der Waals és a hidrogénkötés. A fent említett poláris kovalens kötésben az elektronok megoszlása nem egyenlő. Amikor két ilyen molekula érintkezésbe kerül és egymással ellentétesen van feltöltve, akkor egy dipól-dipól kölcsönhatás következik be, amely vonzza őket. A gyenge molekuláris erők, a londoni diszperziós erő, a Van der Waals és a hidrogénkötés többi példája annak eredménye, hogy a hidrogénatomok egy másik atomhoz kötődnek egy poláris kovalens kötésen keresztül. Ezek a kötések gyengék, de nagyon fontosak a biológiai rendszerekben.