Tartalom
Az enzimek kritikus fehérjemolekulák az élő rendszerekben, amelyeket szintetizálva általában nem alakulnak át más molekulákká, mint például az emésztő és légzőszervi folyamatokban üzemanyagként bevitt anyagok (például cukrok, zsírok, molekuláris oxigén). Ennek oka az, hogy az enzimek katalizátorok, ami azt jelenti, hogy részt vehetnek a kémiai reakciókban, anélkül, hogy megváltoznának, kissé olyan, mint egy nyilvános vita moderátora, aki ideális esetben a résztvevőket és a közönséget a következtetés felé mozgatja, az érvelés diktálásával, miközben nem ad hozzá semmiféle egyedi információt.
Több mint 2000 enzimet azonosítottak, és mindegyik részt vesz egy specifikus kémiai reakcióban. Az enzimek tehát szubsztrátspecifikusak. Fél tucat osztályba csoportosítják őket a reakciók típusa alapján.
Az enzim alapjai
Az enzimek hatalmas számú reakciót tesznek lehetővé a testben, körülmények között homeosztázis, vagy az általános biokémiai egyensúly. Például sok enzim a legjobban a test által fenntartott pH-értékhez (savassághoz) hasonlóan működik, amely 7 tartományban van (vagyis sem lúgos, sem savas). Más enzimek a környezetük igényei miatt alacsonyabb pH-n (magas savasságú) működnek a legjobban; például a gyomor belseje, ahol bizonyos emésztő enzimek működnek, erősen savas.
Az enzimek részt vesznek a vérrögképződéstől a DNS szintézisig és az emésztésig terjedő folyamatokban. Néhányat csak a sejtekben találnak meg, és olyan folyamatokban vesznek részt, amelyekben részt vesznek a kis molekulák, például a glikolízis; mások közvetlenül a bélbe választódnak ki, és ömlesztett anyagokra, például a lenyelött ételekre hatnak.
Mivel az enzimek meglehetősen nagy molekulatömegű fehérjék, mindegyikük megkülönböztetett háromdimenziós alakú. Ez meghatározza azokat a konkrét molekulákat, amelyekre hatnak. Amellett, hogy a pH-tól függ, a legtöbb enzim alakja hőmérséklettől is függ, ami azt jelenti, hogy a legjobban működnek meglehetősen szűk hőmérsékleti tartományban.
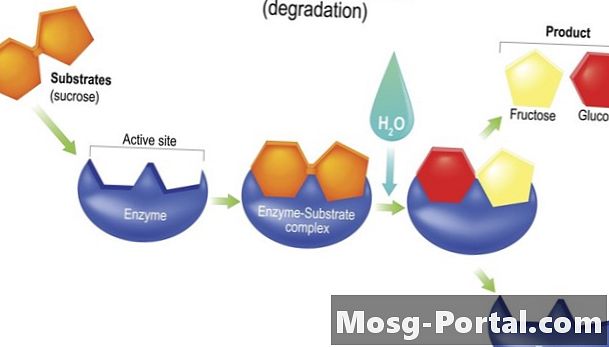
Hogyan működnek az enzimek?
A legtöbb enzim úgy működik, hogy csökkenti a aktiválási energia kémiai reakció. A forma néha összehozza a reagálókat fizikailag egymáshoz, például egy sportcsapat edzője vagy egy munkacsoportvezető stílusában, amelynek célja a feladat gyorsabb elvégzése. Úgy gondolják, hogy amikor az enzimek egy reagenshez kötődnek, alakjuk olyan módon változik, hogy destabilizálja a reagenst, és érzékenyebbé tegye azt a kémiai változásokat, amelyek a reakció során bekövetkeznek.
Azokat a reakciókat, amelyek energia bevitele nélkül folytatódhatnak, exoterm reakcióknak nevezzük. Ezekben a reakciókban a termékek vagy a reakció során képződött vegyi anyagok alacsonyabb energiaszinttel bírnak, mint a vegyületek, amelyek a reakció alkotóelemeként szolgálnak. Ily módon a molekulák, mint például a víz, "megkísérlik" saját (energia) szintjét; az atomok "inkább" alacsonyabb összenergiájú elrendezésben vannak, akárcsak a víz folyik lefelé a legalacsonyabb elérhető fizikai ponthoz. Mindezt összefoglalva egyértelmű, hogy az exoterm reakciók mindig természetesen zajlanak.
Az a tény, hogy a reakció még bemenetek nélkül is megtörténik, nem mond semmit a reakció bekövetkezésének sebességéről. Ha egy testbe bevitt anyag természetesen két származékos anyaggá válik, amelyek közvetlen sejtenergia-forrásként szolgálhatnak, akkor ez nem jár jó, ha a reakció természetesen órákon vagy napokon át tart. Továbbá, még ha a termékek teljes energiája is nagyobb, mint a reagenseké, az energiaút nem egy sima lejtő lejtőn egy grafikonon; ehelyett a termékeknek magasabb energiaszintet kell elérniük, mint amelyikkel elkezdték, hogy "átjuthassanak a púphoz", és a reakció folytatódjon. A reaktorokba történő energia kezdeti beruházása, amely termékek formájában kifizetődik, a fentebb említett az aktiválás energiájavagy Eegy.
Az enzimek típusai
Az emberi test az enzimek hat fő csoportját vagy osztályát foglalja magában.
oxidoreduktázok fokozza az oxidációs és redukciós reakciók sebességét. Ezekben a reakciókban, amelyeket redox reakcióknak is neveznek, az egyik reagens elektronpárt ad fel, amelyet egy másik reagens nyer. Az elektronpár-donorról azt mondják, hogy oxidált és redukálószerként működik, míg az elektron-pár-recipiens redukálódik, oxidálószernek nevezik. Ennek megfogalmazásának egyszerűbb módja az, hogy ilyen típusú reakciókban az oxigénatomok, a hidrogénatomok vagy mindkettő mozog. Ilyenek például a citokróm-oxidáz és a laktát-dehidrogenáz.
transzferázok sebesség az atomcsoportok, például a metil (CH3), acetil (CH3CO) vagy amino (NH2) csoportok egyik molekuláról a másikra. Az acetát-kináz és az alanin-dezamináz a transzferázok példái.
hidrolázok felgyorsítja a hidrolízis reakciókat. A hidrolízis során vizet (H2O) egy kötés megbontása egy molekulában két leánytermék előállításához, általában úgy, hogy a vízből -OH (hidroxilcsoport) -ot rögzítünk a termékek egyikéhez és egy -H (hidrogénatomot) a másikhoz. Időközben egy új molekula képződik az -H és -OH komponensek által kiszorított atomokból. Az emésztő enzimek lipáz és szacharáz hidrolázok.
liázok fokozza az egy molekuláris csoport kettős kötéshez történő hozzáadásának vagy két csoport eltávolítását a közeli atomokból kettős kötés létrehozásának sebességét. Ezek úgy működnek, mint a hidrolázok, azzal a különbséggel, hogy az eltávolított komponenst a víz vagy a víz egy részei nem mozgatják el. Az enzimek ebbe az osztályába tartozik az oxalát-dekarboxiláz és az izocitrát-láz.
izomerázok fel kell gyorsítani az izomerizációs reakciókat. Ezek olyan reakciók, amelyek során a reagensben az összes eredeti atom megmarad, de átrendeződnek úgy, hogy a reagens izomerét képezzék. (Az izomerek molekulák ugyanazon kémiai képlettel, de eltérő elrendezéssel.) Példák a glükóz-foszfát-izomeráz és az alanin racemáz.
ligázok (szintetázoknak is nevezik) növelik két molekula összekapcsolódásának sebességét. Ezt általában az adenozin-trifoszfát (ATP) bomlásából származó energia felhasználásával érik el. A ligázok példái az acetil-CoA-szintetáz és a DNS-ligáz.
Enzimgátlás
A hőmérséklet és a pH változásain kívül más tényezők is eredményezhetnek enzimaktivitás csökkenését vagy leállítását. Az alloszterikus kölcsönhatásnak nevezett folyamat során az enzim alakja átmenetileg megváltozik, amikor a molekula egy részéhez kötődik, attól a helytől, ahonnan csatlakozik a reaktánshoz. Ez a funkció elvesztéséhez vezet. Időnként ez akkor hasznos, ha maga a termék alloszterikus gátlóként szolgál, mivel ez általában annak a jele, hogy a reakció arra a pontra halad, amikor a kiegészítő termékre már nincs szükség.
Versenyképes gátlás esetén egy szabályozó vegyületnek nevezett anyag verseng a reagenssel a kötőhelyért. Ez hasonló ahhoz, hogy megpróbáljon több működtető kulcsot ugyanabba a zárba helyezni egyszerre. Ha ezeknek a szabályozó vegyületeknek elegendő része csatlakozik a jelenlévő enzim elég nagy mennyiségéhez, akkor lelassul vagy leáll a reakció útja. Ez hasznos lehet a farmakológiában, mivel a mikrobiológusok olyan vegyületeket hozhatnak létre, amelyek versenyeznek a bakteriális enzimek kötőhelyeivel, és ezáltal a baktériumok számára sokkal nehezebb betegséget okozni vagy fennmaradni az emberi testben.
Nem versenyképes gátlás esetén egy gátló molekula az enzimhez az aktív helytől eltérő helyen kötődik, hasonlóan ahhoz, ami egy alloszterikus kölcsönhatás során történik. Irreverzibilis gátlás akkor fordul elő, amikor az inhibitor tartósan kötődik az enzimhez vagy jelentős mértékben lebontja azt, hogy funkciója nem helyreállhat. Az ideggáz és a penicillin is használják ezt a gátlást, bár tömegesen eltérő szándékokkal szem előtt tartva.