Tartalom
- TL; DR (túl hosszú; nem olvastam)
- Hogyan számoljuk a vakondokat
- Átalakítás Mmol-ra
- Oldatkoncentráció
- Példa
A számítások egyszerűsítése érdekében a vegyészek egy szabványos egységet hoztak létre egy adott vegyület atomszámához, amely részt vesz egy reakcióban vagy más kémiai folyamatban. Meghatározják egy mol (mol) bármely anyag mennyiségét, amelynek alapvető egységei ugyanolyan számúak, mint 12 gramm széndioxid, azaz Avogadros-szám (6,022 × 1023). Az SI (metrikus) mérési rendszer meghatározza a millimolt (Mmol), mint a mol egy ezredrészét. Általában úgy számítja ki, hogy hány anyag molot tartalmaz, megmérve a kezedben lévő mennyiséget. Ha Mmol-ba szeretne konvertálni, szorozza meg tízszer3 (1,000).
TL; DR (túl hosszú; nem olvastam)
Egy mól egyenlő az adott vegyület Avogadros részecskeszámával. Egy millimól (Mmol) a mol egy ezredrésze.
Hogyan számoljuk a vakondokat
Az atomtömegeket atomtömeg-egységekben (AMU) kell mérni. Az egyik AMU pontosan 1/12-e a szén-12 atom atommagjának tömegének alapállapotában. Egy anyag egy mólját úgy kell meghatározni, hogy az megegyezzen az anyag részecskék Avogadros-számával. E meghatározás szerint az anyag egy mol móltömege grammban megegyezik az adott anyag egyes részecskéinek tömegével az AMU-ban. Például a szén-12 atomtömege 12 AMU, tehát egy mol szén-12 súlya 12 gramm.
Vegyünk egy hidrogén gázzal (H2). A tartályban lévő egyes részecskék egy molekula, amely két hidrogénatomból áll, így a molekulatömeg kiszámításához csak a hidrogén atomtömegére van szükség. A periódusos rendszer legtöbb változata felsorolja az egyes elemek atomtömegét a szimbólum alatt. A hidrogén esetében, amelynek a magjában egyetlen proton van, 1,008 AMU, amely az összes természetes hidrogénizotóp átlaga. Következésképpen a hidrogéngáz atomtömege 2,016 AMU, és egy mol hidrogéngáz súlya 2,016 gramm. A mintában levő molok számának meghatározásához meg kell mérni a mintát grammban, és ezt a tömeget el kell osztani a hidrogén gáz molekulatömegével, grammban. Például egy 15 gramm tiszta hidrogéngázt tartalmazó mintában 7,44 mól van.
Átalakítás Mmol-ra
A vizsgált mennyiségek néha annyira kicsik, hogy az anyajegyek kifejezése nehézkes. Írja be a millimolt. Ha az anyajegyek számát megszorozzuk ezerrel, nagyon kicsi számot konvertálhat jobban kezelhetõvé. Ez különösen kényelmes, ha a térfogati egységeket milliliter sorrendben kezeljük.
1 mol = 1000 mmol
Oldatkoncentráció
A kémikusok a molaritást mérik az oldatban lévő adott vegyület koncentrációjának mérésére. A molaritást a molekulák literben kifejezett számaként határozzák meg. A molaritást millimolaritássá konvertálhatja 1000-szeres szorzással. Például egy 1 mol (moláris, M-ként is írva) oldat koncentrációja 1 mol / liter. Ez megegyezik egy 1000 mmól (millimoláris, néha mM-kel is írott) oldatnak, amely literben 1000 mmól tartalmaz.
Példa
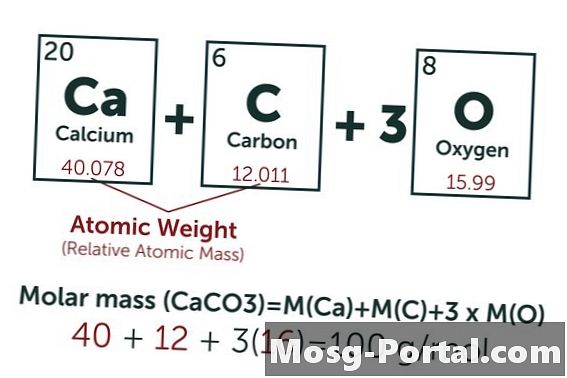
Az oldat 0,15 gramm kalcium-karbonátot tartalmaz. Hány millimól ez?
A kalcium-karbonát kémiai képlete a CaCO3. A szén (C) atomtömege körülbelül 12 AMU, az oxigén (O) körülbelül 16 AMU, a kalcium (Ca) pedig körülbelül 40 AMU. Így minden kalcium-karbonát-molekula súlya 100 AMU, ami azt jelenti, hogy egy mol egy kb. 100 gramm. 0,15 gramm tömeg 0,15 g / 100 g / mol = 0,0015 mol. Ez egyenértékű 1,5 mmol-nal.
Mi a moláris és millimolaritású e sok kalcium-karbonát 2,5 liter oldatban?
A molaritást úgy definiálják, mint az egy literre eső molok számát, tehát ossza meg a molok számát 2,5-del, hogy megkapja a molaritást: 0,0015 ÷ 2,5 =
0,0006 M
Szorozzuk meg 1000-vel, hogy megkapjuk a millimolaritást =
0,6 mM
Vegye figyelembe, hogy ugyanazt az eredményt kapja meg a millimolaritás, ha elosztja a millimolok számát az oldat térfogatával.